


?最近做實驗不順利,經(jīng)常得不到目標蛋白,要么就是蛋白損失很大。怎么辦呢?
由于超濾管使用不恰當或是超濾知識缺乏引起的問題,簡直成了實驗汪們蛋白實驗不成功、效率低下的最常見原因之一。比如說:
為什么我截留分子量選擇沒錯,蛋白有時候卻會漏出在濾出液中?
為什么我用濃縮后的蛋白做下游分析的時候發(fā)現(xiàn)有干擾?
用超濾管來分離兩種蛋白可以嗎?
有時候我用超濾離心管連水都離不下來,可能的原因是?
超濾管可以用來脫鹽和濃縮核酸嗎?
如何給超濾管滅菌?

于是,膜過濾和超濾專家專門寫了一篇攻略,幫助實驗小白們成功在通往技術(shù)大牛的道路上打怪升級。
廢話不多說,上干貨,小板凳搬好了哦!
我們先來看看重點問題怎么解決
Q
為什么我截留分子量選擇沒錯,
蛋白有時候卻會漏出在濾出液中?
A
導(dǎo)致漏蛋白甚至檢測不到蛋白的原因很復(fù)雜,應(yīng)優(yōu)先根據(jù)樣品調(diào)整工藝,因為同一種膜、截留分子量和裝置組合對于不同的蛋白質(zhì)類別甚至物種而言可能并非最優(yōu)之選。
在選擇過程中,應(yīng)首先執(zhí)行以下步驟:
考慮樣品和分子特性:比如改變pH 可能增加構(gòu)象改變的風險,而降低溫度可能降低濃縮效率等。
選擇正確的膜:眾所周知,超濾沒有太多的膜選項,但您應(yīng)對再生纖維素(RC)、Hydrosart? 和聚醚砜(PES)材料進行測試,以確定哪種材料可為您的特定材料提供最低的非特異性結(jié)合和最優(yōu)的回收率。
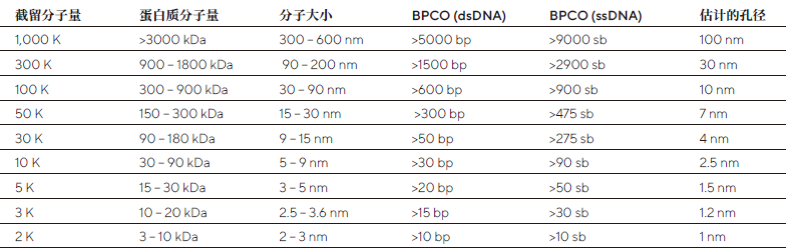
選擇合適的截留分子量,通常是靶標1/3大小的截留分子量最適合。但有時則需要更小的孔徑來滿足回收率的要求。如果在病毒和核酸樣品,可參看下面截留分子量和病毒顆粒分子大小以及核酸大小的換算表。
選擇合適的裝置:賽多利斯擁有適用于低濃度樣品、DNA、蛋白質(zhì)、病毒、過濾應(yīng)用等廣泛的裝置選項;選擇合適的裝置可以有效改善結(jié)果。
使用合適的裝置處理方法:例如預(yù)沖洗以去除分析物或用非干擾蛋白沖洗以鈍化結(jié)合位點并減少損失。
考慮樣品控制方法,例如使用裝置內(nèi)的“死體積”移走所有截留物,或預(yù)灌裝濾液管以控制截留物的最終體積。
截留分子量和病毒顆粒分子大小以及核酸大小的換算表
Q
為什么我用濃縮后的蛋白
做下游分析的時候發(fā)現(xiàn)有干擾?
A
超過濾薄膜含有微量甘油和疊氮化鈉。如果此材料干擾分析,可用緩沖液或去離子水預(yù)清洗。如果干擾仍然存在,用 0.1 N NaOH 清洗,然后用緩沖液或去離子水再次清洗后甩干。如果必須用NaOH處理的時候,推薦試用聚醚砜(PES)膜,因為比(再生纖維素)RC膜更耐NaOH,同時提醒NaOH不能過夜浸泡。
Q
用超濾管來分離兩種蛋白可以嗎?
A
因為超濾膜的孔徑不是規(guī)則的結(jié)構(gòu),所以不能進行精確的分離,所以按照經(jīng)驗,我們推薦兩個蛋白的分子量要相差一個數(shù)量級(10倍)以上才可以進行分離。另外,賽多利斯獨有的300k,1000k和0.2um的超濾管可以實現(xiàn)10倍以上分子量差異的蛋白粗分離。
小編為大家整理了精編完整版《實驗室超濾常見問題》 ,想了解其他注意事項的童鞋可以戳下面的按鈕獲取全文哦!現(xiàn)在還有試用活動進行中,可以免費獲得RC超濾管一支~





掃一掃關(guān)注我們
Copyright ? 2008-2013 廣州格盧瑞生命科學有限公司ALL Rights Reserved | 聯(lián)系方式:0755-2980 9687
技術(shù)支持:三五互聯(lián)